RevBio a développé une formulation à résorption plus rapide de son biomatériau adhésif osseux pour la dentisterie implantaire, qui sera utilisé dans cette étude
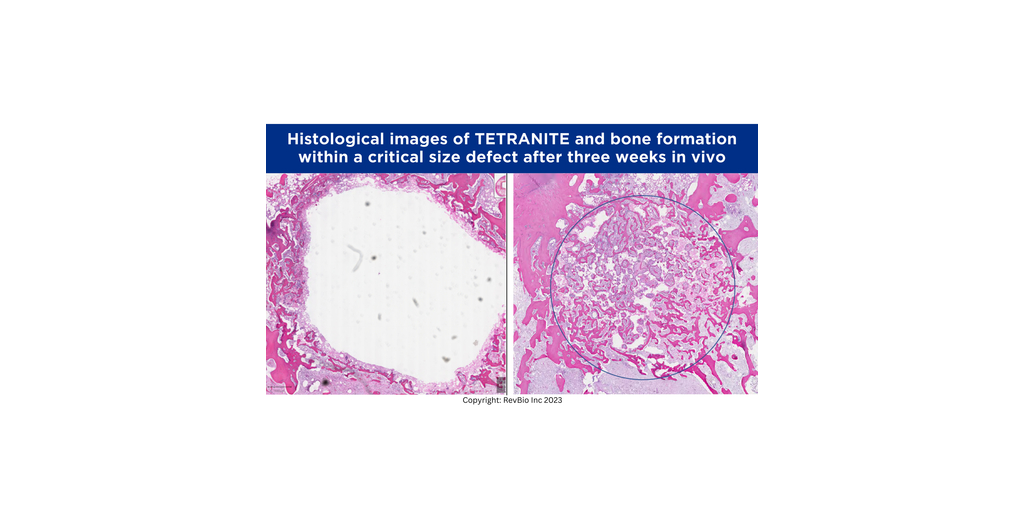


LOWELL, Massachusetts--(BUSINESS WIRE)--RevBio, Inc. fait savoir qu’elle a reçu l’approbation de la Food and Drug Administration américaine pour démarrer un essai clinique sur 20 patients dans le but d’examiner la sécurité et l’efficacité d’une formulation poreuse à pH modifié et à résorption plus rapide du biomatériau adhésif osseux de la société appelé Tetranite® afin de stabiliser immédiatement les implants dentaires à la suite d’extractions dentaires. Il a été démontré que cette nouvelle formulation permettait une substitution osseuse plus active sur le plan biologique. Bien qu’elle ne soit pas ostéoinductrice, cette version de Tetranite en instance de brevet a montré des caractéristiques qui peuvent être décrites comme « ostéopromotrices ».
L’essai clinique va être mené par Paul A. Fugazzotto, DDS, un parodontiste de renommée mondiale basé dans le Massachusetts, qui a plus de 30 ans d’expérience dans la pose d’implants dentaires, et Kanyon Keeney, DDS, un chirurgien oral et maxillo-facial basé en Virginie dont la pratique clinique se concentre exclusivement sur la chirurgie des implants dentaires. « Ce produit est véritablement transformationnel », a déclaré le Dr Fugazzotto. « Tetranite est appelé à révolutionner les méthodes de l’implantologie dentaire. Les propriétés adhésives et les caractéristiques de manipulation de ce matériau sont incomparables à celles de tous les produits disponibles sur le marché. »
Les extractions dentaires sont dues à des lésions traumatiques, à des caries ou à des maladies des gencives. La norme de soins actuelle consiste en des procédures chirurgicales en plusieurs étapes pour restaurer la dentition du patient avec des couronnes prothétiques soutenues par des implants dentaires. Les foyers d’extraction sont souvent trop importants pour que les implants dentaires puissent atteindre une stabilité primaire par le biais d’un engagement mécanique conventionnel. Les patients doivent alors subir un processus coûteux, complexe et long, comprenant une greffe osseuse préliminaire avant de recevoir un implant dentaire. Selon les études de la société, chaque année aux États-Unis, environ 2,1 millions d’implants sont finalement placés dans des sites d’extraction dentaire initialement instables qui doivent d’abord recevoir une greffe osseuse. Le recours à Tetranite pour stabiliser un implant instable permettra la pose immédiate d’implants dentaires qui, autrement, ne pourraient pas être posés tant que la greffe osseuse initiale n’a pas cicatrisé pour former de l’os nouveau. Par conséquent, le biomatériau Tetranite® contribuera à réduire la durée et la complexité de ces procédures d’implantation dentaire, à diminuer la douleur du patient et le temps de récupération, et à réduire le coût global des soins, offrant ainsi un meilleur accès aux patients pour le traitement de la perte de dents.
« Nous sommes vraiment ravis de mener cette étude à la fois avec le Dr Fugazzotto, qui lancera cette étude en recrutant les premiers cas, ainsi qu’avec le Dr Keeney », a déclaré Alan Pollack, directeur principal des opérations cliniques dentaires de RevBio. « Les améliorations que nous avons apportées à la technologie ont accéléré à la fois le profil de substitution osseuse et la force d’adhésion du produit. Ayant récemment reçu l’approbation de l’IRB, nous sommes impatients de recruter nos premiers patients dans les semaines à venir ».
À propos de RevBio, Inc.
RevBio, Inc. est une société de dispositifs médicaux en phase clinique engagée dans le développement et la commercialisation d'un biomatériau adhésif osseux synthétique, injectable, autodurcissant et ostéoconducteur breveté appelé Tetranite®. La société développe initialement cette technologie pour une utilisation sur les marchés dentaire, crânien et orthopédique au sens large, ainsi que pour des applications sur le marché de la santé animale. La technologie Tetranite de RevBio n'est pas encore approuvée pour une utilisation commerciale.
Le texte du communiqué issu d’une traduction ne doit d’aucune manière être considéré comme officiel. La seule version du communiqué qui fasse foi est celle du communiqué dans sa langue d’origine. La traduction devra toujours être confrontée au texte source, qui fera jurisprudence.
Contacts
Michael Tiedemann
mtiedemann@revbio.com
617-763-0923